Quercetin
Quercetin gehört zu der Stoffklasse der Flavonoide und wird in dieser als Flavonol bezeichnet. Quercetin kommt sowohl rein als auch als Glycosid in Pflanzen vor. Bekannte Glycoside des Quercetins sind Rutin, Quercitrin und Hyperosid.
Quercetin und seine Glycoside sind in der Pflanzenwelt weit verbreitet. So findet es sich zum Beispiel im Liebstöckel und in der Goldrute. Quercetin und seine Glycoside können auch als Farbstoffe verwendet werden. Beispiel dafür ist die flavonoidhaltige amerikanische Färbereiche, dessen Rinde zur Färbung von Kleidung eingesetzt werden kann.
Chemische Eigenschaften
Quercetin ist, wie alle Flavonole, an C-3 Position hydroxyliert. Insgesamt trägt es fünf Hydroxygruppen und eine Ketofunktion. Das gelbe Pulver ist nicht in Wasser und nur schwer in Ethanol löslich. Es kann jedoch mit verdünnter NaOH-Lauge in Lösung gebracht werden.
Quercetin trägt selbst kein Stereozentrum und ist somit achiral.
NMR-Analyse
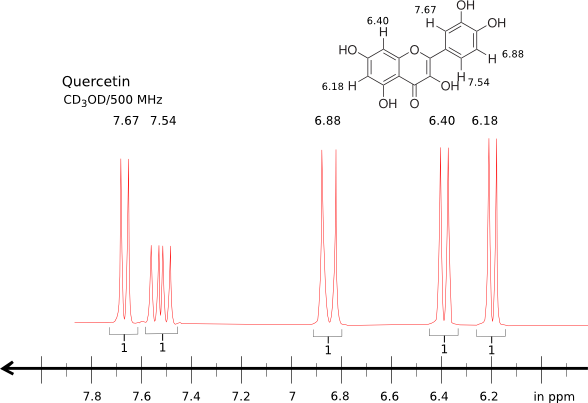
Bei der NMR-Analyse können insgesamt 10 Protonen analysiert werden. Bei deuterierten Lösungsmitteln, welche Protononen austauschen (wie zum Beispiel deuteriertes Methanol) können die Protonen der Alkoholgruppen nicht analysiert werden. Diese werden mit Deuterium ersetzt, welche nicht NMR aktiv sind.
Simuliertes NMR-Spektrum mithilfe von Literaturdaten in CD3OD [1]
Für Quercetin ergibt sich in deuterierten Methanol:1)
1H-NMR (CD3OD, 500 MHz) δ [ppm] = 7.67 (d, 1H, J = 2.29 Hz), 7.54 (dd, 1H, J = 8.39, 2.29 Hz), 6.88 (d, 1H, J = 8.39 Hz), 6.40 (d, 1H, J = 2.29 Hz), 6.18 (d, 1H, J = 1.91 Hz).
In deuterierten DMSO-d6 werden zudem die 5 Hydroxyprotonen gefunden:2)
1H-NMR (DMSO-d6, 500 MHz) δ [ppm] = 12.50 (s, 1H), 10.61 (s, 1H), 9.42 (s, 1H), 9.21 (s, 1H), 9.12 (s, 1H), 7.68 (s, 1H), 7.54 (d, 1H), 6.90 (d, 1H), 6.41 (s, 1H), 6.20 (s, 1H).
13C-NMR (DMSO-d6, 125 MHz) δ [ppm] = 176.3, 164.4, 161.3, 156.7, 148.2, 147.4, 145.6, 136.2, 122.6, 120.5, 116.1, 115.7, 103.6 (2C), 98.7, 93.9.
Bei der Analyse der Glycoside werden die Protonen meist im Bereich zwischen 3-4 ppm gefunden. Die acetalischen Protonen dagegen sind im Bereich von 5 ppm. Je nach Zucker finden sich auch charakteristische Banden, wie zum Beispiel das CH3 Signal bei Rhamnose.
Biosynthese
 Biosynthese von Quercetin
Biosynthese von Quercetin
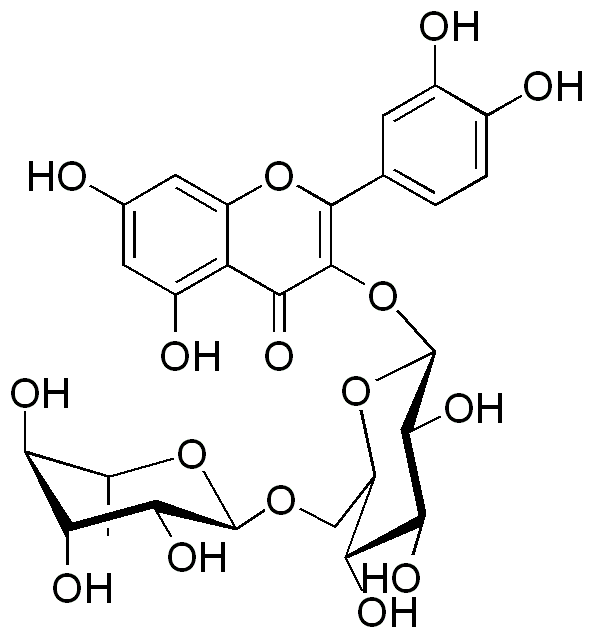 Rutin
Rutin
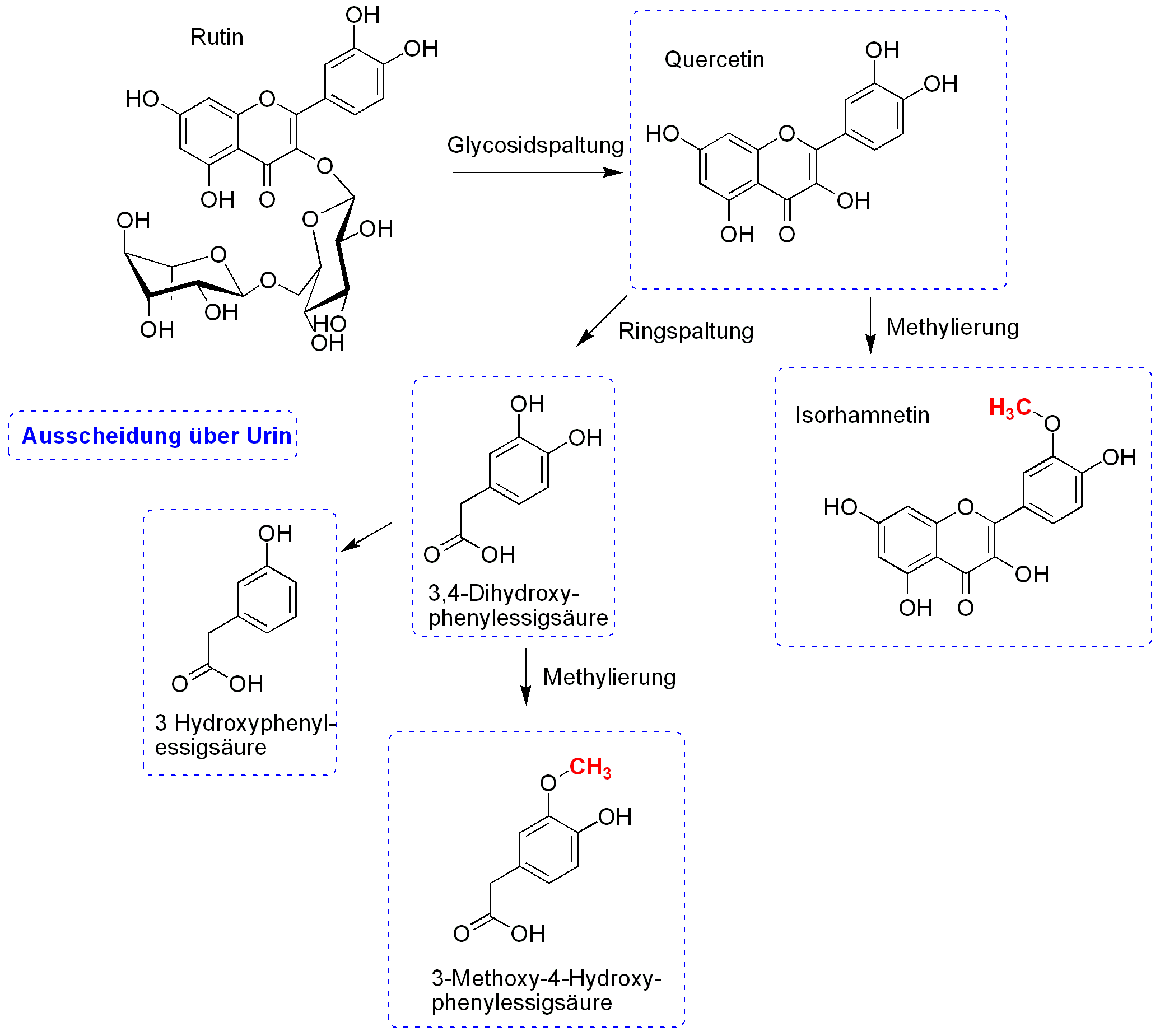 Abbau des Rutins im menschlichen Körper nach Olthof et al.3)
Abbau des Rutins im menschlichen Körper nach Olthof et al.3)
 Hyperosid
Hyperosid
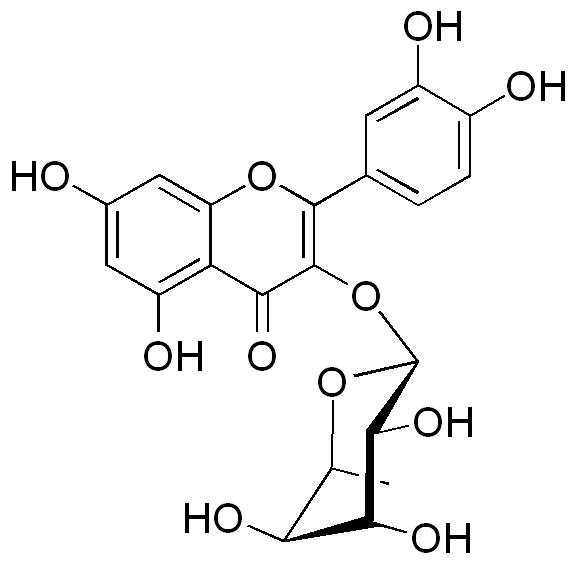 Quercitrin
Quercitrin
Bei der Biosynthese von Quercetin stehen den Pflanzen verschiedene Wege offen das Quercetin zu synthetisieren. Die Einführung der OH Gruppe an C-3' Position kann dabei sowohl ganz am Anfang, mittendrin, als auch am Ende der Syntheseroute geschehen. Daher sind mehrere Synthesewege möglich.
Die Biosynthese von Quercetin geht, wie bei allen Flavonoiden, von p-Cumaroyl-CoA aus. Die Umsetzung von p-Cumaroyl-CoA zu Narginin wird bei der Biosynthese der Flavonoide näher erläutert. Analog dazu wird Kaffeoyl-CoA zu Eriodyctiol umgesetzt.
Durch die Flavanon-3-Hydroxylase entsteht Dihydrokaempferol bzw. Dihydroquercetin. Entsteht Dihydrokaempferol muss dieses katalysiert durch die Flavonoid-3'-Hydroxylase zu Dihydroquercetin umgesetzt werden.
Dihydroquercetin kann schlussendlich durch die Flavonolsynthase zu Quercetin umgesetzt werden.4),5)
Glycoside
Die Glycoside des Quercetins sind in diversen Pflanzne unter anderen im Goldrutenkraut, Buchweizenkraut, in Lindenblüten, Arnikablüten und Eucalyptusblätter vorhanden.
Rutin
Rutin ist ein Glycosid des Quercetins. Das Aglycon ist an der Hydroxygruppe des C-3 Atoms mit Rutinose glycosiliert. Rutinose ist ein Disascharid welches sich aus Rhamnose und Glucose zusammensetzt. Dabei ist Quercetin direkt mit β-D-Glucose an der Acetalgruppe des Zuckers gebunden. Glucose ist an C-6 Position mit α-L-Rhamnose ebenfalls an der Acetalgruppe der Rhamnose verbunden.
Anwendung
Rutin ist Inhaltsstoff diverser Venenmittel. Durch die schlechte Wasserlöslichkeit wird dabei Rutin oft in Hydroxyethylrutinoside umgesetzt, die besser vom Körper aufgenommen werden können. Ein solches Rutinderivat ist zum Beispiel Troxerutin, bei dem alle freie Hydroxygruppen des Aglycons mit Ethanol verethert sind. Troxerutin wird bei venösen Beinleiden zur Stärkung der Venen eingesetzt.
Ausreichende klinische Studien am Menschen zur Wirkung von Rutin und seinen Derivaten stehen allerdings noch aus.
Metabolismus im Menschen
In einer Studie der Arbeitsgruppe Olthof et al.6) wurde der Metabolismus des Rutins als phenolischer Bestandteil des Tees untersucht. Dazu wurden die Metaboliten durch die Massenspektrometrie analysiert.
Im ersten Schritt wird Rutin zu Quercetin deglycosidiert. Das Quercetin wird zu einem Teil im Urin ausgeschieden, aber auch weiter metabolisiert. So wird durch eine Ringspaltung 3,4-Dihydroxyphenylessigsäure dargestellt. Diese kann entweder zu 3-Hydroxyphenylessigsäure dehydroxiliert oder zu 3-Methoxy-4-Hydroxyphenylessigsäure methyliert werden.
Quercetin kann jedoch nach Methylierung auch als Isorhamnetin ausgeschieden werden.
Die beiden Methylierungen finden in der Leber und Niere statt, während der Umbau von Quercetin zu den Hydroxyphenylessigsäuren im Kolon geschieht. Über die Hälfte des oral verabreichten Rutins wird in diese phenolische Metaboliten umgesetzt.
Die Phenylessigsäuren besitzen in vitro eine antioxidative Wirkung, welche jedoch geringer ist, als die des Quercetins. Folgerichtig wird durch die Metabolisierung die antioxidative Wirkung des Flavonoids geschwächt.
Hyperosid
Hyperosid ist das 3-O-Galactosid des Quercetins. Es kommt als solches in der Natur zum Beispiel im rundblättrigen Sonnentau, im Buchweizenkraut und im Mädesüßkraut vor.
Hyperosid kann als Referenzsubstanz zur Bestimmung von Flavonoiden durch HPLC Verfahren eingesetzt werden.
Quercitrin
Quercitrin ist ein Glycosid des Quercetins, welches mit L-Rhamnose glycosidiert ist.
Quercitrin ist Bestandteil des natürlichen Farbstoffes Quercitrons. Quercitron ist ein gelber Farbstoff der aus der Färbereiche (Quercus velutina) gewonnen werden kann und neben Quercitrin Tannine und Quercitin enthält. Zum Färben wird die innere Rinde der Eiche verwendet.