Flavonoide
Die Flavonoide sind eine Stoffgruppe innerhalb der sekundären Pflanzenstoffe. Innerhalb der Pflanze treten diese meist als Glycoside auf. Die Aglycone, die sich mit Ausnahme der Isoflavonoide von Flavan ableiten, können jedoch ebenfalls in der Pflanze vorkommen.
Durch die verschiedenen Glycosidierungsmuster und die Variation der Aglycone umfassen die Flavonoide eine große Stoffgruppe. Diese besitzen jedoch alle eine gemeinsame Biosynthese aus Phenylalanin, welches aus dem Shikimisäureweg stammt. Flavonoide wurden lange Zeit als Farbstoffe eingesetzt.
Vorkommen & Verwendung
Die Flavonoide sind eine im Pflanzenreich ubiquitär auftretende Stoffklasse. Das heißt, dass sie in jeder höheren Pflanze enthalten sind. Daher treten sie auch in diversen Pflanzendrogen und Extrakte, wie zum Beispiel in Kamillenblüten und Lindenblüten.
 Centaurea cyanus, die Kornblume, verdankt ihre Blütenfarbe dem Flavonoid-Komplex Protocyanin (aus Bilder ur Nordens Flora)
Centaurea cyanus, die Kornblume, verdankt ihre Blütenfarbe dem Flavonoid-Komplex Protocyanin (aus Bilder ur Nordens Flora)
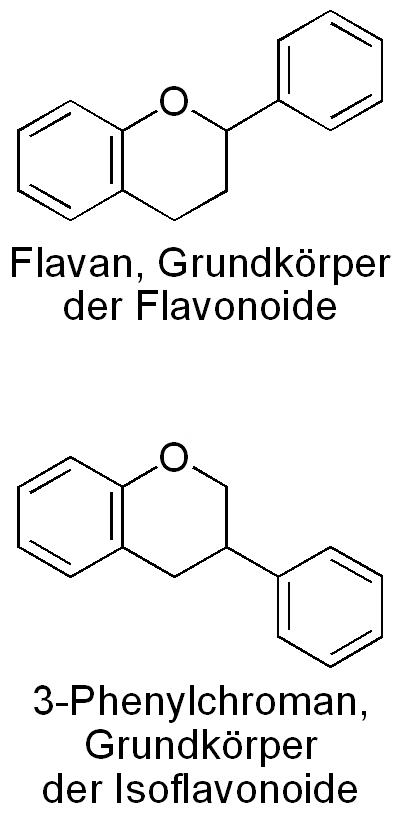 Grundstruktur der Flavonoide
Grundstruktur der Flavonoide
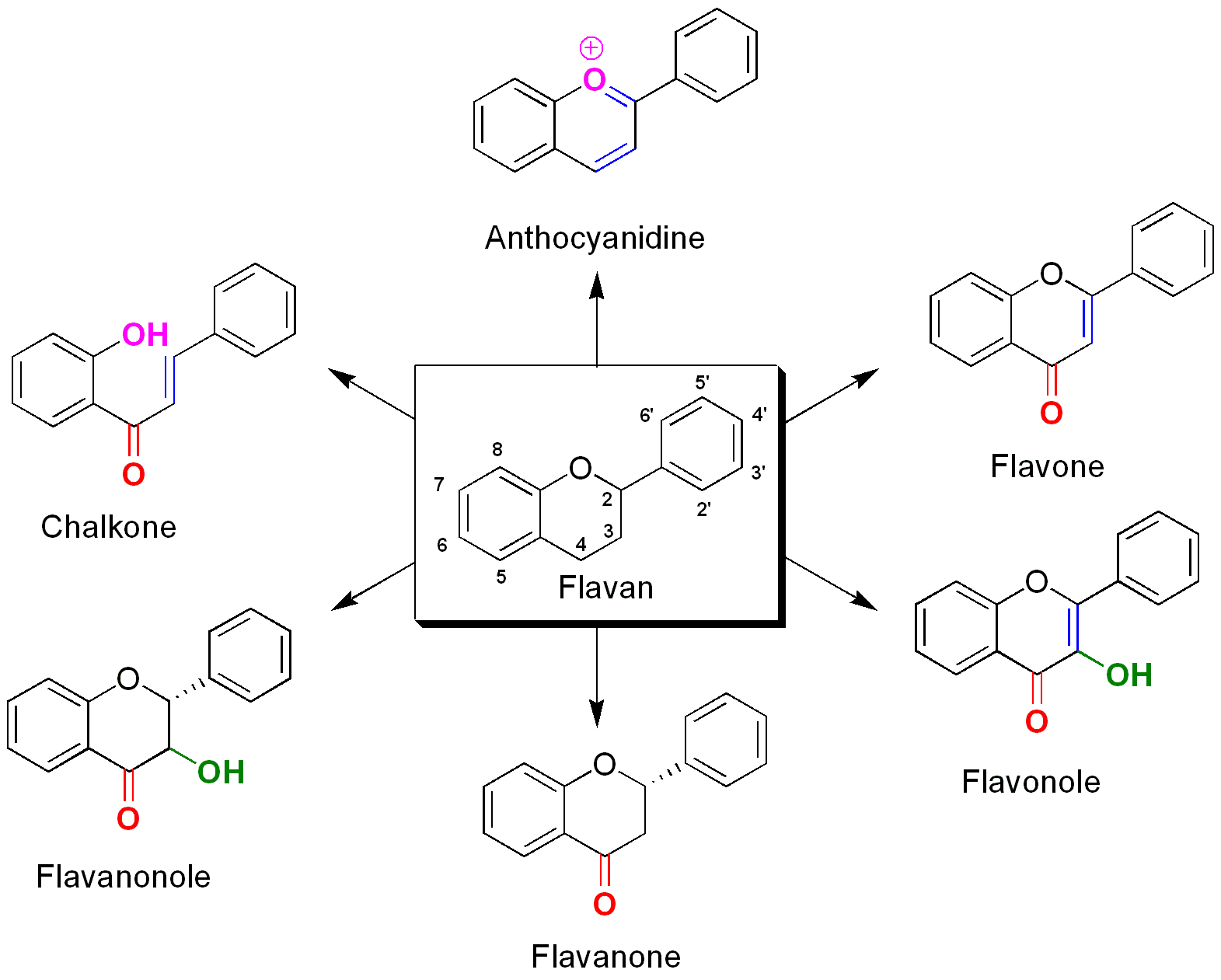 Übersicht über die Stoffklassen der Flavanoide
Übersicht über die Stoffklassen der Flavanoide
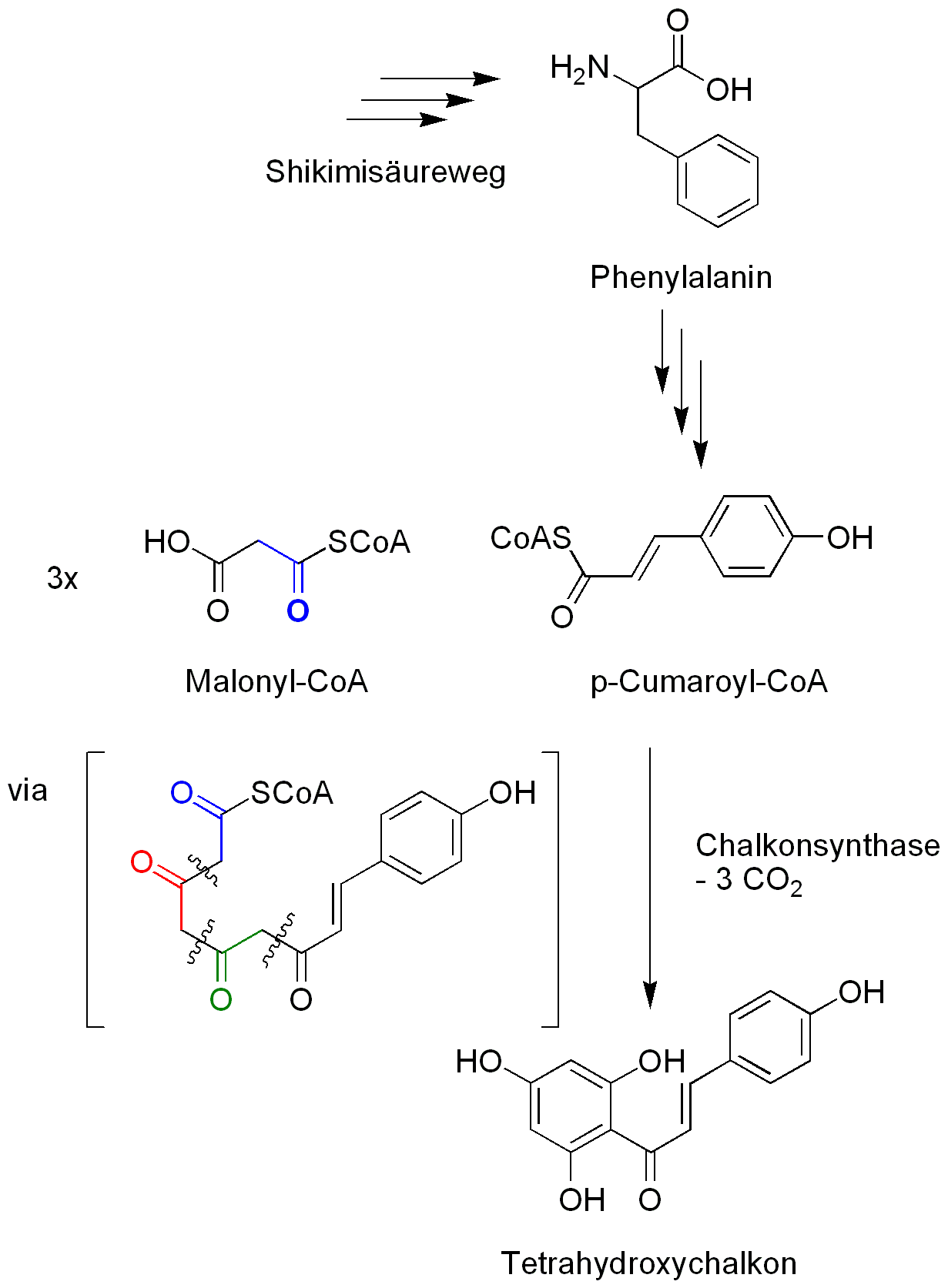 Biosynthese der Flavonoidvorstufe Tetrahydroxychalkon
Biosynthese der Flavonoidvorstufe Tetrahydroxychalkon
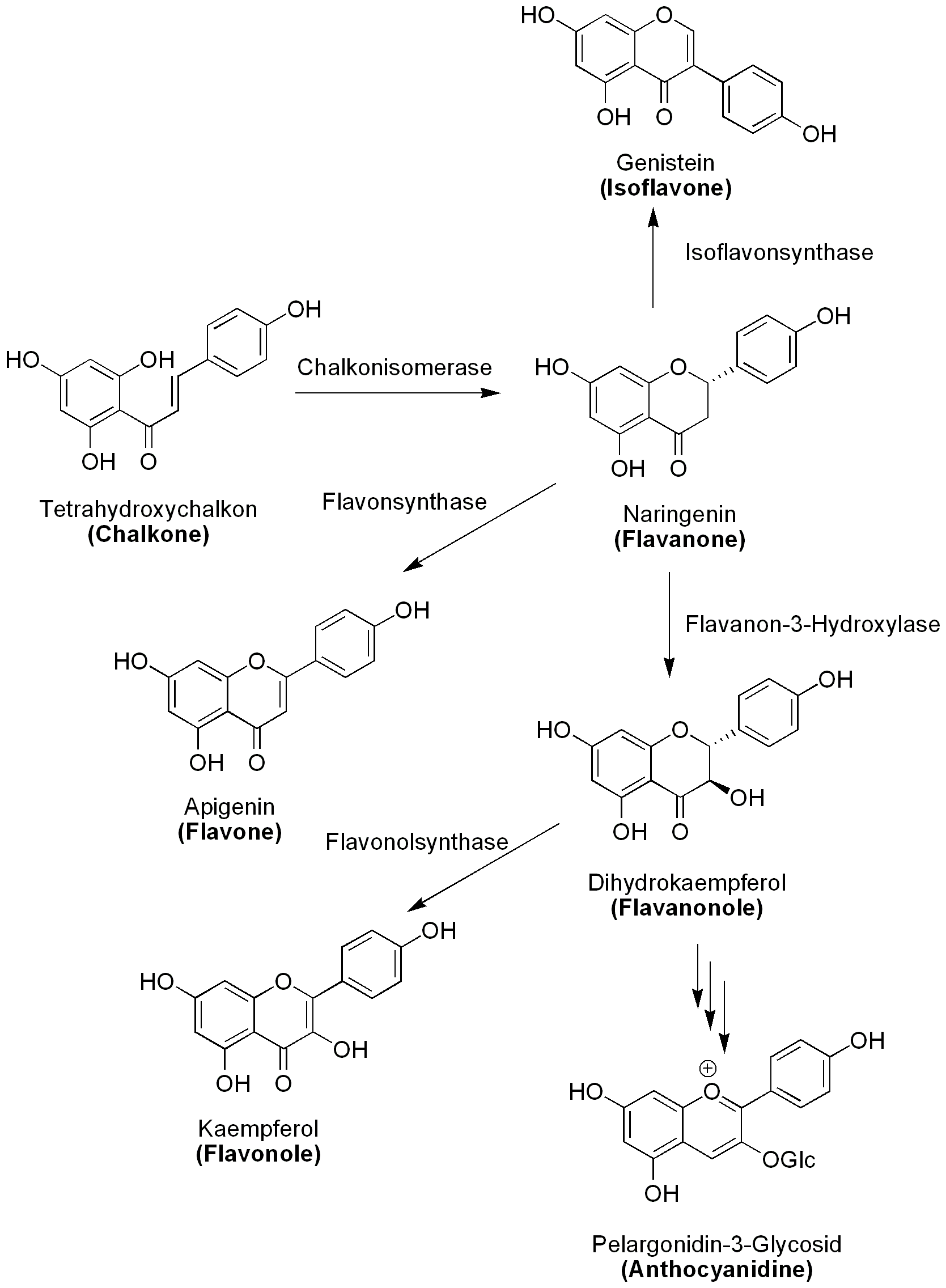 Biosynthese der verschiedenen Flavonoidklassen
Biosynthese der verschiedenen Flavonoidklassen
 Beispiel einer weiteren Substituierung
Beispiel einer weiteren Substituierung
 Hesperidin aus der Schale von Zitrusfrüchten
Hesperidin aus der Schale von Zitrusfrüchten
Durch diese Vielfalt werden Flavonoide in vielen Bereichen eingesetzt. Zum einen sind Flavonoide Bestandteil vieler Arzneipflanzen, tragen jedoch nicht immer zur Wirkung bei. Ein Flavonoid, welches als Medikament eingesetzt werden kann, ist Rutin. Dieses ist in vielen Pflanzen vorhanden und kann zum Beispiel aus Buchweizenkraut isoliert werden. Es kann zur Blutstillung eingesetzt werden.
Neben medizinischen Aspekten können Flavonoide vorallem als Farbstoffe eingesetzt werden. Stoffe wie Luteolin und diverse Anthocyanidine können zur Gelb-, Rot und Blaufärbung eingesetzt werden. So ist Malvidin mitverantwortlich für die Rotfärbung des Rotweins.
Die Flavonoide, darunter vorallem die Anthocyanidine, sind in der Lage mit Ionen Komplexe zu bilden, die zur Pigmentbildung führen. Ein solcher Komplex ist Protocyanin, welches für die blaue Farbe der Kornblume verantwortlich ist.1)
Struktur
Mit Ausnahme der Isoflavonoide leiten sich diese von ihrer gemeinsamen Grundstruktur, dem Flavan (2-Phenylchroman) ab. Die Isoflavonoide leiten sich strukturell von einem Konstitutionsisomer des Flavans, dem 3-Phenylchroman ab. Die Flavonoide und Isoflavonoide lassen sich in weitere Unterklassen, je nach Substitution der Grundstruktur einteilen.
Flavone
Die Flavaone besitzen in C-4 Position eine Ketogruppe und zwischen C-2 und C-3 findet sich eine Doppelbindung. Das C-3 Atom ist bei den Flavonen nicht weiter substituiert. Zu den Flavonen zählen die gelben Farbstoffe Luteolin und Apigenin sowie das Chrysin.
Flavonole
Im Gegensatz zu den Flavonen befindet sich bei den Flavonolen in C-3 Position eine Hydroxygruppe. Ein bekanntes Flavonol ist Kaempferol. Die Flavonole können mit zum Beispiel Aluminium chelatisiert werden und bilden gelbe Komplexe aus.
Flavanone
Bei den Flavanonen besteht zwischen C-2 und C-3 lediglich eine Einfachbindung. Dadurch entstehen an den beiden Atomen Stereozentren. Mit den Flavonen und den Flavonolen haben die Flavanone die Ketofunktion an C-4 gemeinsam. Zu den farblosen Flavanone gehört zum Beispiel das Naringenin.
Flavanonole
Wie bei den Flavonole, ist bei den Flavanonolen die C-3 Position hydroxiliert.
Chalkone
Die Chalkone sind durch die Ringöffnung durch die Chalkon-Flavanon-Isomerase (siehe unter Biosynthese) charakterisiert. Die Chalkone sind isomer zu den Flavanonen und können in diese umgewandelt werden. In den Pflanzen spielen sie eine marginalisierte Rolle.
Anthocyanidine
Die Anthocyanidine sind ionische Verbindungen. Insgesamt sind nur wenige Anthocyanidine, wie Malvidin bekannt. Diese spielen vor allem als Farbstoffe eine wichtige Rolle.
Isoflavonoide
Bei den Isoflavonoiden steht die Phenylgruppe nicht an C-2 sondern an C-3 Position. Die Isoflavonoide lassen sich, wie die Flavonoide in verschiedene Untergruppen wie Isoflavane und Isoflavandiole unterteilen. Zu den Isolflavonoiden zählt zum Beispiel Genistein.
Biosynthese
Die Biosynthese der Flavanoide beginnt bei der Aminosäure Phenylalanin. Diese wird im Shikimisäureweg synthetisert. Aus Phenylalanin wird in mehreren Schritten p-Cumaryl-CoA synthetisiert, welches der direkte Ausgangsstoff der Flavonoide ist. Von p-Cumaryl-CoA können auf verschiedene Arten Flavonoide erzeugt werden.2) Der hier dargestellte Biosyntheseweg zeigt eine dieser Möglichkeit, wobei in diesem Weg Vertreter aller beschriebenen Flavonoidstoffklassen synthetisiert werden können.
p-Cumaryl-CoA wird in einem ersten Schritt, ähnlich zu der Biosynthese der Polyketide mittels Malonyl-CoA dreimal jeweils um 2-C Atome verlängert. Dabei wird CO2 freigesetzt. Danach cyclisiert das im Zwischenschritt entstandene Polyketid. Bei der durch die Chalkonsynthase katalysierten Reaktion entsteht Tetrahydroxychalkon.
Tetrahydroxychalkon ist das erste Flavonoid, welches auf diesem Biosyntheseweg synthetisert wird. Es gehört zu den Chalkonen. Chalkone können durch die Chalkonisomerase in Flavanone umgewandelt werden. In unserem speziellen Fall wird Tetrahydroxychalkon zu Naringenin isomerisiert, welches zur Stoffklasse der Flavanone gehört.
Hier zweigt auch die Biosynthese der Isoflavonoide ab (welche allerdings auch auf anderen Weg synthetisiert werden können). Durch das Enzym Isoflavonsynthase wird aus Naringenin Genistein gebildet.
Naringenin kann jedoch auch zu Apigenin oxidiert werden. Dabei wird unter Katalyse des Enzyms Flavonsynthase eine Doppelbindung zwischen C-2 und C-3 eingeführt. Es entsteht ein Vertreter der Flavone.
Zur Synthese weiterer Flavonoide wird Naringenin an C-3 Position stereoselektiv hydroxyliert. Dabei entsteht Dihydrokaempferol. Die Flavanon-3-Hydroxylase katalysiert diese Reaktion zur Bildung der Flavanonole.
Wie bei der Entstehung von Apigenin kann nun Diydrokaempferol zu Kaempferol oxidiert werden. Das unterstützende Enzym heißt Flavonolsynthase, welches die Synthese der Flavonole zulässt.
Schlußendlich kann in mehreren darauffolgenden Schritten aus Dihydrokaempferol das Pelargonidin-3-Glycosid gebildet werden. Dieses Anthocyanidin stellt den Endpunkt dieses Synthesewegs dar, kann jedoch noch weiter glycosidiert werden.3)
Die Synthese anders substituierter Flavonoide kann durch direkte Modifizierung der jeweiligen Verbindung geschehen, also zum Beispiel durch die Hydroxlierung von Naringenin an C-5' Position (äquivalent zur C-3' Position) zu Eriodyctiol, oder durch Modifizierung des Ausgangsstoffes p-Cumaryl-CoA zu Kaffeoyl-CoA.4)
Glycoside
Die bisher dargestellen Flavonoide kommen in Pflanzen oft glycosidiert vor. Die Aglycone werden vorwiegend an den Alkoholgruppen der C-3 und C-7 Atome, aber auch bei C-6 und C-8 glycosidiert. Mehrere Zucker kommen dafür in betracht. Daher ergibt sich durch verschieden Glycosidierungsmuster eine Vielzahl an weiteren Flavonoiden.
Ein Beispiel für ein solches Glycosid ist Hesperidin. Dies ist das Hauptflavonoid der Schalen von Zitronen (siehe auch Zitronenöl) und Orangen (ebenso Orangenöl), aus welchen es auch zum ersten Mal isoliert wurde. Das Aglycon des Hesperidin, das Hesperitin, ist mit Ritosin glycosidiert. Ritosin ist ein Disaccharid aus β-D-Glucose und α-L-Rhamnose, welche 1 → 6 verknüpft sind.